
Thecla betulae (Nierenfleck-Zipfelfalter) (Linnaeus, 1758)
Verbreitung in Deutschland: Thecla betulae ist in Deutschland weit verbreitet und meist ungefährdet und häufig. Für erhöhte Gefährdungseinschätzungen ist gewöhnlich ein unzureichender Kenntnisstand der Verbreitung und Häufigkeit der Art verantwortlich, da T. betulae als Falter nur schwierig nachweisbar ist (Settele et al. 2025). Größere Verbreitungslücken existieren im Norden Deutschlands, vor allem in Mecklenburg-Vorpommern, Schleswig-Holstein, Niedersachsen und Nordrhein- Westfalen (Reinhardt et al. 2020). Bundesweit gilt die Art aktuell als ungefährdet (Musche et al. 2025).
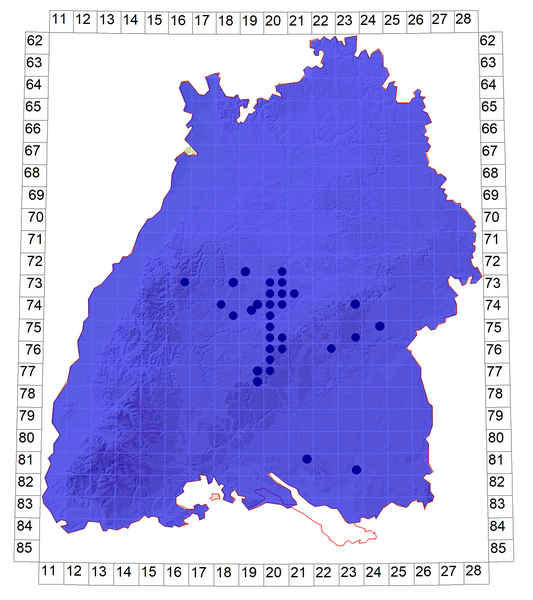
Verbreitung in Baden-Württemberg: Wahrscheinlich ist der Nierenfleck-Zipfelfalter in fast ganz Baden-Württemberg ohne größere Verbreitungslücken anzutreffen. Allein in Bereichen des mittleren und nördlichen Schwarzwaldes könnten natürliche Verbreitungslücken bestehen. Besonders häufig ist die Art in warmen und schlehenreichen Naturräumen (südlicher Oberrhein, Kraichgau, Albvorland, Tauberland), zahlreiche Nachweise existieren aber auch von der Schwäbischen Alb (Ebert & Rennwald 1991b). In Oberschwaben ist T. betulae nur regional häufiger, etwa am Bodensee oder im Schussental, ansonsten ist sie selten, da auch die Wirtspflanzen wenig verbreitet sind.
Habitatansprüche: Überall dort, wo Prunus-Gewächse an zumindest teilbesonnten Standorten auftreten, ist auch mit T. betulae zu rechnen. Typische Habitate sind besonnte Waldsäume, Heckenlandschaften, Parks und Gärten, Streuobstwiesen, aber auch Böschungen und Dämme, Kiesgruben und Steinbrüche. Auch innerhalb des Waldes kommt die Art an Waldinnenrändern und auf Kahlhieben vor. Die Raupe lebt an verschiedenen Prunus-Arten, bevorzugt an der Schlehe (Prunus spinosa), daneben aber auch an diversen Obstbäumen (Zwetschge, Pflaume, Mirabelle oder Kirsche) und an der Traubenkirsche (Prunus padus) (Ebert & Rennwald 1991b). Die Eier finden sich häufig an jungen Zweigen der Schlehe, wo sie aufgrund ihrer hellweißen Färbung und Größe relativ auffällig sind und sich gut vom dunklen Untergrund des Astes abheben (Hermann 2007). Kull et al. (2025) konnten eine Präferenz für vergleichsweise niedrige Schlehenbüsche und Bereiche innerhalb von Ortschaften nachweisen.
Gefährdung/Schutz: RL BW: Ungefährdet (Steiner & Trusch 2025). Zwar wird auch diese Art durch Entsaumung und Verdunkelung der Wälder zurückgehen, sie ist aber weiterhin im Offenland durchaus häufig und fast überall (als Ei) nachweisbar. Die Nierenfleck-Zipfelfalter ist eine der wenigen Arten, die von der Nutzungsaufgabe von Grenzertragsstandorten und zunehmender Sukzession, z. B. in Form von Gebüschen und (Schlehen-)Hecken, zumindest über einen gewissen Zeitraum profitieren können. Trotzdem ist für diese Art Sukzession nicht notwendig, da sie auch in extensiv bewirtschaftetem Gelände ausreichend Möglichkeiten zur Eiablage findet.
Eignung als Indikatorart: T. betulae hat aktuell kaum Indikatorpotential.
Bestimmung: Der Falter ist aufgrund seiner charakteristischen Färbung sowohl ober- als auch unterseits unverwechselbar. Auch die weiß gefärbten Eier sind an Schlehe sehr gut von denjenigen des Pflaumen-Zipfelfalters (Satyrium pruni) und des Kleinen Schlehen-Zipfelfalters (Satyrium acaciae) unterscheidbar (Hermann 2007).
Quellen für diese Seite:
Ebert, G. & E. Rennwald (Hrsg.) (1991b): Die Schmetterlinge Baden-Württembergs. Band 2, Tagfalter 2. Ulmer-Verlag (Stuttgart), 535 S.
Hermann, G. (2007): Tagfalter suchen im Winter/Searching for butterflies in winter: Zipfelfalter, Schillerfalter und Eisvögel/Hairstreaks, Purple Emperors & White Admirals. - Books on Demand, 228 S.
Kull, S., Köhler, H. R. & G. Markl (2025): Das Eiablageverhalten des Nierenfleckzipfelfalters Thecla betulae (Lepidoptera, Lycaenidae) in Südwestdeutschland. - Carolinea 83: doi 10.64134/carolinea/83.1.1-7.
Musche, M., Albrecht, M., Becker, J., Bittermann, J., Blanckenhagen, B. von, Böck, O., Caspari, A., Caspari, S., Dolek, M., Harpke, A., Hermann, G., Joger, H. G., Kolligs, D., Lange, A., Müller, D., Nunner, A., Pollrich, S., Reinelt, T., Rennwald, E., Schmitz, O., Schönborn, C., Schulze, W., Schurian, K., Strätling, R., Wachlin, V. & M. Wiemers (2025): Rote Liste und Gesamtartenliste der Tagfalter und Widderchen (Lepidoptera: Papilionoidea et Zygaenidae) Deutschlands. – Naturschutz und Biologische Vielfalt 170 (11): 94 S.
Reinhardt R., Harpke A., Caspari, S., Dolek, M., Kühn, E., Musche, M., Trusch, R., Wiemers, M. & J. Settele (Hrsg.) (2020): Verbreitungsatlas der Tagfalter und Widderchen Deutschlands. - Ulmer Verlag (Stuttgart), 428 S.
Settele, J., Steiner, R., Reinhardt, R., Feldmann, R., Hermann, G., Musche, M., Kühn, E. & G. Brehm (2025): Schmetterlinge - Die Tagfalter und Widderchen Deutschlands. - Ulmer Verlag (Stuttgart), 288 S.
Steiner, A. & R. Trusch (2025): Rote Liste und Verzeichnis der Schmetterlinge Baden-Württembergs. – 4. Fassung, Stand 31.12.2023. – Naturschutz-Praxis Artenschutz 18, Landesanstalt für Umwelt Baden-Württemberg, Karlsruhe, 156 S.
Nierenfleck-Zipfelfalter (Thecla betulae) auf einer Sturmwurffläche in den Oberen Gäuen (Mötzingen), August 2009.

T. betulae im Albvorland (NSG Schaichtal), August 2008.

Portrait von T. betulae im Albvorland (NSG Schaichtal), September 2008.

Flügeloberseite von T. betulae im Albvorland (NSG Schaichtal), September 2008.

Weibchen des Nierenfleck-Zipfelfalters auf der mittleren Schwäbischen Alb (Wiesensteig), September 2022.

Ei des Nierenfleck-Zipfelfalters in den Oberen Gäuen (Schafhausen), März 2018.

Detailaufnahme eines Eis von T. betulae auf der Schwäbischen Alb (NSG Ruchberg), September 2016.

Ei von T. betulae an einer Schlehe in den Oberen Gäuen (Gültlingen).

Von T. betulae mit Eiern belegter Schlehenbusch auf der Schwäbischen Alb (NSG Ruchberg).

Diese Halbtrockenrasen-Hänge im Albvorland (Dettenhausen), an denen die Sukzession weitgehend ungehindert voranschreitet, sind gut geeignete Habitate für den Nierenfleck-Zipfelfalter.

Südexponierter Waldsaum mit reichlich Schlehen im Unterwuchs als charakteristisches Eiablage-Habitat des Nierenfleck-Zipfelfalters im Albvorland (NSG Schaichtal).

Eiablagehabitat von T. betulae in einem Bachtal mit südexponiertem Wegsaum im Albvorland (Waldenbuch).

Reproduktionshabitat des Nierenfleck-Zipfelfalters im Albvorland (Öschingen); ein Kleinkahlhieb mit Schlehenvorkommen.

Auch im Nordschwarzwald - wie hier bei Nonnenmiß - kommt die Art an geeigneten Stellen wie dieser südexponierten, mit Schlehen bestandenen Böschung vor.

Schematische Verbreitung von T. betulae in Baden-Württemberg:
Dunkelblauer Bereich: Belegte Vorkommen
Schwarze Punkte: Eigene Nachweise Stand 2022
Hamearis lucina, Callophrys rubi, Thecla betulae, Favonius quercus, Satyrium acaciae, Satyrium ilicis, Satyrium w-album, Satyrium spini, Satyrium pruni, Lycaena helle, Lycaena phlaeas, Lycaena dispar, Lycaena virgaureae, Lycaena tityrus, Lycaena alciphron, Lycaena hippothoe, Cupido minimus, Cupido osiris, Cupido argiades, Celastrina argiolus, Pseudophilotes baton, Glaucopsyche alexis, Phengaris alcon, Phengaris rebeli, Phengaris arion, Phengaris teleius, Phengaris nausithous, Plebejus argus, Plebejus idas, Plebejus argyrognomon, Aricia agestis, Aricia artaxerxes, Eumedonia eumedon, Agriades optilete, Cyaniris semiargus, Polyommatus damon, Polyommatus dorylas, Polyommatus amandus, Polyommatus thersites, Polyommatus icarus, Polyommatus daphnis, Lysandra coridon, Lysandra bellargus